Mật độ thả cao làm giảm hiệu suất tăng trưởng và khả năng kháng bệnh, kích thích tiết ra các enzyme trao đổi chất và ảnh hưởng tiêu cực đến khả năng miễn dịch và các con đường liên quan đến năng lượng ở tôm thẻ chân trắng.

Mật độ thả cao làm giảm hiệu suất tăng trưởng và khả năng kháng bệnh trên tôm thẻ chân trắng
Mật độ thả giống là một trong những yếu tố quan trọng nhất trong nuôi trồng thủy sản. Việc thiết lập mật độ thả giống có thể ảnh hưởng lớn đến hiệu quả kinh tế của việc nuôi tôm và thậm chí trực tiếp quyết định sự thành công hay thất bại của một phương pháp nuôi. Sự thay đổi mật độ thả nuôi có thể mang lại ảnh hưởng rất lớn đến nhiều loài tôm về nhiều mặt trong các môi trường nuôi khác nhau. Hiệu suất tăng trưởng và khả năng miễn dịch của tôm thẻ chân trắng bị ảnh hưởng đáng kể bởi mật độ thả giống, dù ở giai đoạn ấu trùng hay trưởng thành, bất kể trong ao, bể ngoài trời, hệ thống nước xanh, hệ thống biofloc hay nước ngọt.
Ngoài ra, sự thay đổi mật độ thả giống cũng có ảnh hưởng nhất định đến hiệu quả sản xuất giống của tôm. Hơn nữa, các phản ứng trao đổi chất và năng lượng sinh học ở tôm cũng bị ảnh hưởng đáng kể bởi mật độ thả giống khác nhau. Tuy nhiên, kiến thức về ảnh hưởng của mật độ thả nuôi đối với tôm thẻ chân trắng rất phức tạp và không có hệ thống, và nghiên cứu về cơ chế phân tử còn hiếm. Mặc dù đã có một số ứng dụng công nghệ giải mã trình tự phiên mã ở tôm để phân tích tác động của các yếu tố hóa lý bất lợi bên ngoài đối với loài này, nhưng ảnh hưởng của mật độ thả giống vốn là stress về môi trường đã bị bỏ qua. Do đó, nghiên cứu gần đây của Đại học Hải dương Quảng Đông ngoài việc đánh giá hiệu suất tăng trưởng và khả năng miễn dịch, thì phản ứng của tôm thẻ chân trắng với các mật độ thả giống khác nhau ở cấp độ phân tử đã được nghiên cứu bằng cách sử dụng phân tích phiên mã.
Thiết kế thí nghiệm
Tôm thẻ chân trắng thí nghiệm được lựa chọn ở giai đoạn postlarvae 8. Tôm được cho ăn Artemia và nuôi trong ao bê tông ngoài trời có kích thước 4,5m × 4,9m × 1,8m cho đến khi trọng lượng đạt khoảng 0,3g. Vi khuẩn V. parahaemolyticus được ủ trong môi trường thạch Luria Bertani (LB) đã được làm nóng trước ở 30°C trong 18h, sau đó ly tâm ở 5.000g trong 10 phút ở 4°C và rửa bằng PBS và tạo huyền phù. Cuối cùng, nồng độ của dung dịch vi khuẩn được xác định rồi pha loãng thành 1×107 CFU/mL để sử dụng.
540 cá thể tôm (0,30 ± 0,02 g) được phân phối trong 9 bể (0,3 m³) theo ba nghiệm thức, được thiết lập ở mật độ thả 100, 200 và 300 con/m³, được ghi nhận là nhóm mật độ thả thấp (LSD), nhóm mật độ thả trung bình (MSD) và nhóm mật độ thả cao (HSD). Mỗi nghiệm thức gồm 3 lần lặp lại. Các thí nghiệm được tiến hành trong nhà trong 8 tuần, với nhiệt độ nước 28–30°C, sục khí liên tục, oxy hòa tan >6,8 mg/L, pH 7,8–8,2 và hàm lượng amoniac <0,03 mg/L. Nước sử dụng cho thí nghiệm được lọc và làm sạch từ nước biển tự nhiên có độ mặn 30 ppt. Nước biển tinh khiết đã được khử trùng bằng nguồn ổn định được sử dụng và nước được đo ba lần mỗi ngày vào lúc 7h, 14h và 19h, tương ứng. Tôm được cho ăn 4 lần/ngày lần lượt vào lúc 7h, 11h, 16h và 21h, với lượng thức ăn thí nghiệm ban đầu là 10% trọng lượng cơ thể. 60% lượng nước sử dụng được thay hàng ngày trong mỗi bể. Vào cuối giai đoạn 8 tuần, tôm được nhịn ăn trong 24h trước khi lấy mẫu. Sau khi được đếm để xác định tỷ lệ sống (SR), trọng lượng cơ thể cuối cùng (FBW), tốc độ tăng trưởng (WGR), tốc độ tăng trưởng riêng (SGR) và tỷ lệ hiệu quả sử dụng protein (PER), tôm được thu ngẫu nhiên từ mỗi bể thử nghiệm để phân tích các chỉ số miễn dịch. Sau khi lấy mẫu, 20 con tôm khỏe mạnh được chọn ngẫu nhiên từ mỗi nhóm và giữ trong 72 giờ để thử nghiệm cảm nhiễm. Tôm được tiêm cơ giữa phần bụng thứ hai và thứ ba với vi khuẩn V. parahaemolyticus ở nồng độ 1×107 CFU/mL. Tỷ lệ chết tích lũy của tôm được ghi nhận cứ sau 4 giờ. Quá trình xử lý mẫu, chuẩn bị thuốc thử và xác định mẫu được thực hiện theo đúng hướng dẫn. Kết quả về hiệu suất tăng trưởng và sử dụng thức ăn Hiệu suất tăng trưởng của tôm được thể hiện trong Bảng 1. Kết quả cho thấy tỷ lệ sống, trọng lượng cơ thể cuối cùng, tốc độ tăng trưởng, tốc độ tăng trưởng riêng và tỷ lệ hiệu quả sử dụng protein của tôm giảm trong khi FCR tăng khi mật độ tăng. Trọng lượng cơ thể cuối cùng và tỷ lệ sống của tôm khác nhau đáng kể giữa cả ba nhóm được phát hiện (P><0,05). Trong nhóm mật độ thả cao, tốc độ tăng trưởng, tốc độ tăng trưởng riêng và tỷ lệ hiệu quả sử dụng protein thấp hơn đáng kể trong khi FCR cao hơn đáng kể so với nhóm mật độ thả trung bình và mật độ thả thấp (P >< 0,03 mg/L. Nước sử dụng cho thí nghiệm được lọc và làm sạch từ nước biển tự nhiên có độ mặn 30 ppt. Nước biển tinh khiết đã được khử trùng bằng nguồn ổn định được sử dụng và nước được đo ba lần mỗi ngày vào lúc 7h, 14h và 19h, tương ứng.
Tôm được cho ăn 4 lần/ngày lần lượt vào lúc 7h, 11h, 16h và 21h, với lượng thức ăn thí nghiệm ban đầu là 10% trọng lượng cơ thể. 60% lượng nước sử dụng được thay hàng ngày trong mỗi bể. Vào cuối giai đoạn 8 tuần, tôm được nhịn ăn trong 24h trước khi lấy mẫu. Sau khi được đếm để xác định tỷ lệ sống (SR), trọng lượng cơ thể cuối cùng (FBW), tốc độ tăng trưởng (WGR), tốc độ tăng trưởng riêng (SGR) và tỷ lệ hiệu quả sử dụng protein (PER), tôm được thu ngẫu nhiên từ mỗi bể thử nghiệm để phân tích các chỉ số miễn dịch. Sau khi lấy mẫu, 20 con tôm khỏe mạnh được chọn ngẫu nhiên từ mỗi nhóm và giữ trong 72 giờ để thử nghiệm cảm nhiễm. Tôm được tiêm cơ giữa phần bụng thứ hai và thứ ba với vi khuẩn V. parahaemolyticus ở nồng độ 1×107 CFU/mL. Tỷ lệ chết tích lũy của tôm được ghi nhận cứ sau 4 giờ. Quá trình xử lý mẫu, chuẩn bị thuốc thử và xác định mẫu được thực hiện theo đúng hướng dẫn.
Kết quả về hiệu suất tăng trưởng và sử dụng thức ăn
Hiệu suất tăng trưởng của tôm được thể hiện trong Bảng 1. Kết quả cho thấy tỷ lệ sống, trọng lượng cơ thể cuối cùng, tốc độ tăng trưởng, tốc độ tăng trưởng riêng và tỷ lệ hiệu quả sử dụng protein của tôm giảm trong khi FCR tăng khi mật độ tăng. Trọng lượng cơ thể cuối cùng và tỷ lệ sống của tôm khác nhau đáng kể giữa cả ba nhóm được phát hiện (P<0,05). Trong nhóm mật độ thả cao, tốc độ tăng trưởng, tốc độ tăng trưởng riêng và tỷ lệ hiệu quả sử dụng protein thấp hơn đáng kể trong khi FCR cao hơn đáng kể so với nhóm mật độ thả trung bình và mật độ thả thấp (P ><0,05). Trong nhóm mật độ thả cao, tốc độ tăng trưởng, tốc độ tăng trưởng riêng và tỷ lệ hiệu quả sử dụng protein thấp hơn đáng kể trong khi FCR cao hơn đáng kể so với nhóm mật độ thả trung bình và mật độ thả thấp (P<0,05).
Bảng 1. Hiệu suất tăng trưởng của tôm được nuôi ở các mật độ thả khác nhau
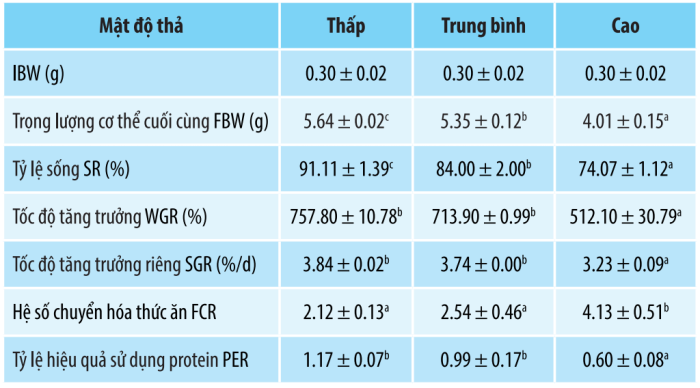
Lưu ý: Giá trị (Trung bình ± SD) với các chữ cái nhỏ khác nhau ở trên có nghĩa là sự khác biệt đáng kể (P < 0,05)
Tỷ lệ sống của tôm sau khi nhiễm V. parahemolyticus
Tỷ lệ sống của tôm thẻ chân trắng sau khi nhiễm V. parahemolyticus giảm dần khi mật độ thả nuôi tăng lên. Tỷ lệ sống của tôm trong nhóm mật độ thả cao (HSD) thấp hơn đáng kể so với nhóm mật độ thấp (LSD) (P<0,05) và nhóm mật độ thả trung bình (MSD) (P><0,05). Tuy nhiên, không có sự khác biệt đáng kể về tỷ lệ sống của tôm giữa nhóm mật độ thả thấp (LSD) và mật độ thả trung bình (MSD) (P ><0,05) và nhóm mật độ thả trung bình (MSD) (P<0,05). Tuy nhiên, không có sự khác biệt đáng kể về tỷ lệ sống của tôm giữa nhóm mật độ thả thấp (LSD) và mật độ thả trung bình (MSD) (P ><0,05). Tuy nhiên, không có sự khác biệt đáng kể về tỷ lệ sống của tôm giữa nhóm mật độ thả thấp (LSD) và mật độ thả trung bình (MSD) (P>0,05).
Kết quả về chỉ số miễn dịch trong huyết thanh
Mật độ thả nuôi có những ảnh hưởng đến hoạt động của các enzyme miễn dịch khác nhau ở tôm. Khi mật độ thả nuôi tăng lên, hoạt động AST, ALT và LYS trong huyết thanh tôm có xu hướng tăng lên, trong khi hoạt động CAT và PO có xu hướng giảm. Trong nhóm mật độ thả cao, hoạt tính AST của tôm tăng đáng kể trong khi hoạt động PO giảm đáng kể khi so sánh với nhóm mật độ thả thấp và mật độ thả trung bình (P<0,05). Biểu hiện của AST và CAT khác biệt đáng kể giữa nhóm mật độ thả thấp và mật độ thả cao (P><0,05). Hoạt động của AST và PO không có sự khác biệt đáng kể ở mật độ thả thấp và mật độ thả trung bình. Trong nhóm mật độ thả trung bình và mật độ thả cao, hoạt động ALT, CAT và LYS không khác biệt đáng kể (P>0,05). Hoạt động của ALT và LYS cao hơn đáng kể trong khi hoạt động CAT thấp hơn đáng kể so với nhóm mật độ thả thấp (P<0,05). Biểu hiện của AST và CAT khác biệt đáng kể giữa nhóm mật độ thả thấp và mật độ thả cao (P><0,05). Không có sự khác biệt đáng kể về hoạt động của ACP, AKP và SOD cũng như hàm lượng MDA giữa các nhóm ở mật độ khác nhau (P>0,05).
Biểu hiện của các gen liên quan đến miễn dịch trong tế bào máu
Với sự gia tăng mật độ thả giống, sự biểu hiện gen AST, ALT và LYS trong tế bào máu của tôm có xu hướng tăng lên, trong khi sự biểu hiện của gen CAT và PO có xu hướng giảm dần. Sự biểu hiện của gen ALT và LYS khác nhau đáng kể giữa ba nhóm ở mật độ thả khác nhau (P<0,05). Biểu hiện của AST và CAT khác biệt đáng kể giữa nhóm mật độ thả thấp và mật độ thả cao (P><0,05). Biểu hiện của AST và CAT khác biệt đáng kể giữa nhóm mật độ thả thấp và mật độ thả cao (P<0,05), trong đó biểu hiện AST và CAT không khác biệt đáng kể so với nhóm mật độ thả trung bình. K><0,05), trong đó biểu hiện AST và CAT không khác biệt đáng kể so với nhóm mật độ thả trung bình. Khi so sánh với nhóm mật độ thả thấp, biểu hiện PO trong nhóm mật độ thả trung bình và mật độ thả cao giảm đáng kể (P<0,05), trong đó biểu hiện AST và CAT không khác biệt đáng kể so với nhóm mật độ thả trung bình. K><0,05), nhưng không có sự khác biệt đáng kể giữa hai nhóm. Sự biểu hiện của gen ACP và SOD ở nhóm mật độ thả trung bình và mật độ thả cao không khác biệt đáng kể, nhưng cả hai đều khác biệt so với nhóm mật độ thả thấp (P<0,05), trong đó biểu hiện AST và CAT không khác biệt đáng kể so với nhóm mật độ thả trung bình. K><0,05). Ngoài ra, biểu hiện AKP không khác biệt đáng kể giữa ba nhóm (P>0,05).
Nhìn chung, mật độ thả cao làm giảm hiệu suất tăng trưởng và khả năng kháng bệnh, kích thích tiết ra các enzyme trao đổi chất và ảnh hưởng đáng kể đến khả năng miễn dịch và các con đường liên quan đến năng lượng ở tôm thẻ chân trắng. Sự giảm hiệu suất tăng trưởng có thể liên quan đến cơ chế phân bổ năng lượng bị thay đổi dưới áp lực của môi trường và việc giảm khả năng kháng bệnh có thể liên quan đến tổn thương oxy hóa và những thay đổi trong gen và con đường miễn dịch.
Th.S Chinh Lê (Lược dịch)
Học viện Nông nghiệp Việt Nam

